Спинални мускулни атрофии (СМА)
Етиология и патогенеза
Най-честата форма на СМА се дължи на мутации в гена, кодиращ протеина - survival motor neuron 1 (SMN1), локализиран върху 5 хромозома. При около 96% от болните е налице делеция (загуба) на екзони 7 и 8 от SMN1- гена, в по-редки случаи само на екзон 7. SMN локусът върху 5 хромозома съдържа и SMN2 ген, който е близък по структура до SMN1. SMN2 е запазен при всички пациенти със СМА, като броят на копията варира от 1 до 4 и може да определи тежестта на заболяването. SMN1 кодира основното количество от пълноверижния SMN протеин, докато 90% от SMN2 иРНК не включва екзон 7, вследствие на което се синтезира бързо разграждащ се SMN протеин. Тази форма са унаследява по АР тип с 25% риск за раждане на болно дете при родители носители на мутация в SMN1.
SMN протеинът е от особена важност за нормалното функциониране на алфа мотоневроните. Заболяването се разделя на следните форми в зависимост от тежестта на мускулното засягане:
- СМА тип 1, при която децата не могат да седят без опора
- СМА тип 2, при която децата могат да седят, но не могат да ходят
- СМА тип 3, при която пациентите могат да ходят
СМА тип 4 с начало в зрялата възраст
Клинични характеристики
Основните симптоми на заболяването включват намален мускулен тонус, прогресираща мускулна слабост предимно в мускулите на тазовия и раменния пояс, булбарна слабост в по-напредналите фази на заболяването. Налице е слабост на междуребрените дихателни мускули при относителна съхраненост на диафрагмата, което води до „камбаноподобна“ форма на гръдния кош и парадоксално дишане. При формата с начало в детска възраст са налице мускулна хипотония и слабост при по-леко проявени булбарно и дихателно засягане.
При СМА тип I началото е в неонаталния период, като пациентите не достигат самостоятелен седеж, леталният изход настъпва в рамките на първите 18 мес. от живота. При СМА тип II болните могат да седят самостоятелно, но не прохождат, а при тип III прохождат, но впоследствие развиват мускулна слабост. При тип IV клиничните прояви започват в юношеската или зрялата възраст.
Изследвания за поставяне на диагнозата
Диагнозата се базира на:
- Клиничните характеристики
- ЕМГ изследването с данни за преднорогова увреда
- КФК варира от нормална да леко повишена
- Окончателната диагноза се поставя чрез молекулярно-генетично изследване (фигура 1). Златен стандарт при генетичната верификация е количествената оценка на SMN1 и SMN2, чрез multiplex ligation dependent (MLPA) или количествена полимеразна верижна реакция или чрез секвениране от ново поколение (NGS), (фигура 1).
Броят на SMN2 копията определя тежестта на заболяването в повечето случаи, макар че съществуват и изключения. Болните със СМА тип 1 имат 2 SMN2 копия, тези със СМА тип 2- 3, тези със СМА тип 3- 4, а при болните със СМА тип 4 SMN2 копията са от 4 до 6.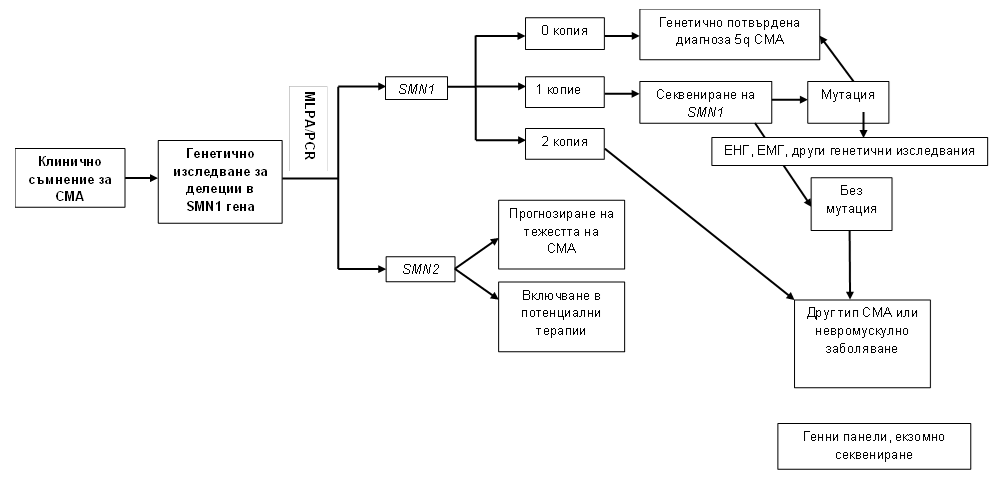
Фигура 1. Диагностичен алгоритъм за пациенти със СМА.
Лечение и проследяване
Лечението и проследяването на пациентите със СМА изисква мултидисциплинарен подход.
Zolgensma (onasemnogene abeparvovec) е първият медикамент за генна терапия на 5q спинална мускулна атрофия, при който се използва адено-асоцииран вирусен вектор серотип 9 (AAV9) за въвеждане на функционално копие на SMN1 гена в мотоневроните. AAV9 преминава кръвномозъчната бариера. Регистриран е от FDA (Food and drug agency) на 24.05.2019 и от ЕМА (European Medicines Agency) на 18.5.2020 г. Показан е за пациенти със СМА с биалелна мутация в гена SMN1 и клинична диагноза СМА тип 1, или пациенти с 5q СМА с биалелна мутация в гена SMN1 и до 3 копия на гена SMN2.
Препоръчителната доза на Zolgensma е 1.1 × 1014 векторни геноми (vg) на кг. тегло.
Преди приложението на медикамента следва да се изследват:
- AAV9 (анти-аденовирусни антитела)
- ПКК
- чернодробна функция: аланин аминотрансфераза (ALT), аспартат аминотрансфераза, (AST) и общ билирубин
- Креатинин
- тропонин-I
Медикаментът се прилага ендократно, като венозна инфузия за 60 мин. Възможна е имунна реакция срещу вирусния капсид, която да доведе до повишаване на чернодробните трансаминази, troponin I или тромбоцитопения. Това налага имуномодулация с кортикостероиди- денят преди инфузията се започва системно приложение в доза еквивалентна 1 мг/кг/ден prednisolone, което продължава 1 мес. Броят на тромбоцитите и чернодробните показатели се оценяват всяка седмица през първия месец и веднъж на две седмици през втория и третия месец.
Противопоказан е при свръхчувствителност на пациента към активното вещество или към някое от помощните вещества.
Ефектът от лечението се проследява чрез CHOP-INTEND скалата при пациентите със СМА тип 1 и Hammersmith Functional Motor Scale Expanded (HFMSE) скалата при СМА тип 2.
Nusinersen (SPINRAZA) е модифициран антисенс олигонуклеотид, който се свързва с интрона, следващ екзон 7 в пре-информационната РНК на SMN2. По този начин модулира сплайсинга на иРНК, за да включи екзон 7 и за да се синтезира по-голямо количество пълноверижен SMN протеин. Това е първият медикамент, одобрен за лечение на всички форми на 5q СМА (през декември 2016 от FDA и през май 2017 от ЕМА). Препоръчителната доза на медикамента е 12 mg (всеки флакон е 5 ml/12 mg), приложени интратекално. Терапията започва с четири натоварващи дози - три през 14 дни и четвъртата 30 дни след третата. След това поддържащите дози се прилагат през четири месеца. При предсимптоматично започнато лечение при болни със СМА тип се наблюдава двигателно развитие, близко до това на здрави деца. При другите клинични проучвания децата на терапия постигат статистически значимо подобрение на двигателните функции. Наблюдава се статистически значимо повишена преживяемост на пациентите със СМА тип 1. Медикаментът е одобрен за всички форми на заболяването и всички възрасти и вече са налице данни за ефективност и безопасност при пациенти над 18 г.
Най-честите нежелани лекарствени реакции са инфекции на горните и долните дихателни пътища, констипация, белодробни ателектази, протеинурия, както и главоболие, гадене и болка в лумбалната област, свързани със самата процедура.
Ефектът от лечението се оценява 3 месеца след шестата и преди седмата доза и след това на всеки 6 месеца, ако лечението продължава.
Пациентът не трябва да се влошава по никой от следните параметри:
1. Обща двигателна функция, измерена по скалата за моторно-двигателни функции на Hammersmith Functional Motor Scale Expanded (HFMSE).
При пациентите със СMA тип 1 оценката на двигателните функции се извършва по скали:
- Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders (CHOP INTEND)
- Hammersmith Infant Neurological Examination (HINE)
При пациентите със СMA тип 2 оценката на двигателните функции се извършва чрез:
- Hammersmith Functional Motor Scale Expanded (HFMSE) score
- Revised Upper Limb (RULM)
- Мануално мускулно тестуване (MRC скала)
При пациентите със СMA тип 3 оценката на двигателните функции се извършва чрез:
- Hammersmith Functional Motor Scale Expanded (HFMSE) score
- Revised Upper Limb (RULM)
- Мануално мускулно тестуване (MRC скала)
- 6 Minutes walking test (6MWT)- при запазена самостоятелно походка
2. Респираторна функция, оценена чрез спирометрия, оценка на PAO2 и PACO2 за период от време без допълнително подаване на кислород.
Лечението с Nusinersen ще се провежда:
- За пациентите на възраст от 0 до 3 г. в Клиниката по детска неврология в УСБАЛДБ „проф. д-р Иван Митев” в гр. София и Клиниката по педиатрия и генетични заболявания в УМБАЛ „Св. Георги” в гр. Пловдив
- За пациенти на възраст от 3 до 18 г. в Клиниката по нервни болести на УМБАЛ „Александровска”, Детска неврологична клиника на УСБАЛНП „Св. Наум” и Клиниката по детска неврология в УСБАЛДБ „проф. д-р Иван Митев” в гр. София и Клиниката по педиатрия и генетични заболявания в УМБАЛ „Св. Георги” в гр. Пловдив
- За пациенти над 18 г. в Клиниката по нервни болести на УМБАЛ „Александровска” и в УСБАЛНП „Св. Наум”
Risdiplam е медикамент за перорално приложение, който модифицира РНК сплайсинга на SMN2, с последващо включване на екзон 7 в иРНК, като по този начин се продуцира пълноверижен и функционален SMN протеин. Медикаментът преминава кръвно-мозъчната бариера и се разпределя както в ЦНС, така и в другите тъкани на организма.
Показан е за пациенти с всички типове на 5q СМА над 2-месечна възраст. Дозира се съобразно телесната маса- 0.2 мг/кг/ден за деца между 2 мес. и 2 г., 0.25 мг/кг/ден за пациенти над 2 г. и телесна маса < 20 кг, и 5 мг. на ден при болни ≥ 2 г. и телесна маса ≥ 20 кг.
Най-честите нежелани лекарствени реакции са кожни обриви, разязвявания на лигавиците на устната кухина, гадене, диария, повишаване на температурата, артралгии.
Физиотерапия - при различните форми от особено значение са следните упражнения: разтягане (вкл. чрез използване на шини и ортези), позициониране, двигателни упражнения, дихателна гимнастика. Те са съобразени с формата и тежестта на СМА и се извършват под контрола на физиотерапевт с опит в областта на НМЗ.
Ортопедични интервенции. При пациентите със СМА тип 1 и 2 сколиозата над 20° трябва да се проследява на всеки 6 мес. преди достигане на костна зрелост и ежегодно след това. Използването на спинални шини се препоръчва при хипотонични деца със сколиоза над 20°, при които има дълъг период до достигане на костната зрелост. Към ортопедична хирургия пациентът се насочва в случаите, когато ъгълът на Cobb ≥50° или нараства с ≥10° на година. Оценяват се и допълнителни фактори като влошаване на дихателните функции, изразена кифоза, нарушен баланс на тялото. Оценката на вентилаторните капацитети е от основно значение преди и след оперативната интервенция. При болните на възраст 8-10 г. се имплантират стабилизатори, позволяващи костен растеж. При пациентите над 12 г. се извършва спинална фузия.
Едностранна или двустранна корекция на тазобедрените стави и ставните контрактури се извършва при пациенти с изразени болки.
Лечение на гастроинтестиналните и гълтателните нарушения. При всички форми на СМА е важна преценката за наличие на гастроезофагеален рефлукс, констипация, забавено стомашно изпразване или повръщане.
При пациентите със СМА тип 1 булбарната слабост с дисфагия и контрактурите на масетерните мускули са типични. Налага се временно поставяне на назогастрална (НГС) или назойеюнна сонда до поставянето на постоянна гастростома. Диетолог преценява необходимите количества хранителни вещества, течности и електролити, които трябва да се приемат за оптимален растеж.
При пациентите със СМА тип 2 гълтателните нарушения са чести и налагат използването на НГС за подпомагане на набавянето на необходимите количества хранителни вещества. Тези болни, както и пациентите със СМА тип 3, загубили самостоятелна походка са с повишен риск от затлъстяване, предвид ограничените движения. В тези случаи те се насочват към диетолог за оптимален хранителен режим. Важно е прецизиране на приема на витамин Д за превенция на остеопения и остеопороза.
Дихателни грижи. Дихателните нарушения са типични при пациентите със СМА.
При СМА тип 1 от особена важност е провеждането на оксиметрия и капнография на всеки 3 месеца, като оценката по време на сън е по-обективна. При установяване на хиповентилация е важно да се осигури оптимална проходимост на дихателните пътища- мануално и чрез механични методи-Cough Assist® или VitalCough®. В началото налягането на инсуфлация и ексуфлация следва да се повишава бавно 30–40 cm H2O позитивно или негативно налягане. Неинвазивната вентилация с позитивно налягане трябва да се използва при всички симптоматични деца със СМА преди изява на симптомите на дихателна недостатъчност. Преценката на режима на вентилация се преценява от анестезиолог-реаниматор с опит в областта на НМЗ. Дихателно подпомагане при показания неинвазивна вентилация с позитивно налягане трябва да се използва при всички симптоматични кърмачета и при не-седящите преди да се развият белези на дихателна недостатъчност. CPAP не трябва да се използва за лечение на хронична дихателна недостатъчност, но може да се използва временно с внимание за поддържане на функционалния резидуален дихателен капацитет при по-малките пациенти, които не могат да синхронизират с вентилатора в НИВ режим и които не са изразено хиперкапнични. Това се отнася и за по-слабите не-седящи. Изключително важен е подборът на подходяща маска, поне два вида, и използването първоначално на назална. При не-седящите силно се препоръчва започването на НИВ чрез клинично титриране и фокус върху корекция на газовия обмен и намаляване усилията на дихателните мускули. Инвазивна вентилация се прилага при недостатъчен ефект от неинвазивната вентилация. Трахеотомията е възможност при отделни пациенти при които неинвазивната вентилация е недостатъчна или неуспешна или ако липсва подходяща маска. Решението трябва да бъде индивидуално в зависимост от клиничния статус, прогнозата и качеството на живот и да се основава на обсъждане със семейството.
Препоръчват се и методи за подобряване на откашлянето – мануално, чрез Амбу или апарати за cough assist.
Бронходилататори се прилагат при съмнение за астма. Муколитици не се прилагат за дълъг период от време.
При пациентите със СМА тип 2 и 3 спирометрия се препоръчва на всеки 6 мес., а при съмнение за нощна хиповентилация се препоръчва провеждането на полисомнографско изследване.
При пациентите с неефективно откашляне поддържането на проходимостта на дихателните пътища чрез мануални или апаратни методи, аналогични на тези на СМА тип 1 е от особено значение. При установяване на дихателна недостатъчност се препоръчва bilevel неинвазивна вентилация. Въпреки че при пациентите със СМА тип 2 и 3 рядко се налага, ако са налице белези на дихателна недостатъчност и липса на ефект от неинвазивната вентилация се прибягва към инвазивна.
Спешни състояния при пациенти със СМА
Банални инфекции могат да влошат състоянието на болните със СМА и да наложат спешна хоспитализация с последващо възстановяване проходимостта на дихателните пътища, неинвазивна или инвазивна вентилация и кислородотерапия. Кислородната суплементация не бива да се прилага емпирично без мониториране на обмена на CO2 и не трябва да се прилага като алтернатива на вентилацията с позитивно налягане. В зависимост от състоянието на болния се прилагат антибиотици, парентерално хранене, възстановяване на водно-електролитния баланс.
Профилактика
Своевременното поставяне на диагнозата при тези пациенти дава възможност за профиктика на нови случаи на заболяването в засегнатите семейства.
Европейски проекти
Успешното проучване на механизмите на възникване и начините за повлияване на НМЗ зависи от координираните усилия на национално и международно ниво


